Configuración Electrónica de Todos los Elementos
Utiliza la clave neoparaiso.com para abrir el PDF.
Algunas características de los átomos de los elementos químicos incluyen:
- Los átomos son las unidades básicas de la materia que forman todos los elementos químicos.
- Los átomos están compuestos de protones, neutrones y electrones.
- El número de protones en el núcleo de un átomo determina su número atómico y el elemento al que pertenece.
- La disposición de los electrones en el nivel de energía más externo de un átomo determina sus propiedades químicas y su reactividad.
- Los átomos pueden combinarse con otros átomos para formar moléculas, que son las unidades básicas de los compuestos químicos.
- Los átomos pueden ganar o perder electrones para formar iones, que tienen una carga neta positiva o negativa.
- El comportamiento y las propiedades de los átomos están determinados por su configuración electrónica.
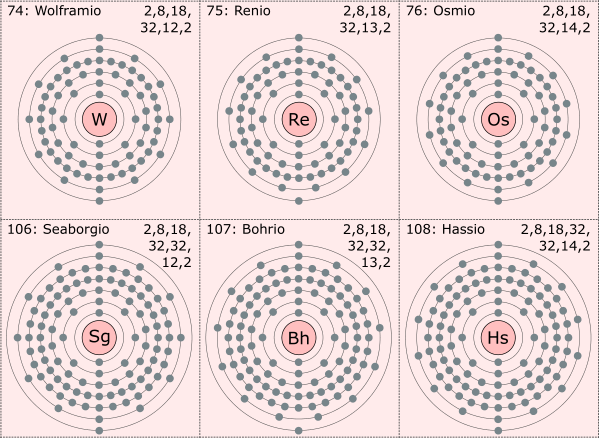
La configuración electrónica de los átomos es un tema en química porque está estrechamente relacionada con el comportamiento y las propiedades de los átomos. La disposición de los electrones en un átomo determina su reactividad química, así como sus propiedades físicas y químicas. Por ejemplo, la configuración electrónica de un átomo puede determinar si es probable que forme enlaces con otros átomos y qué tipo de enlaces es probable que forme. Por lo tanto, comprender la configuración electrónica de los átomos es importante para predecir y explicar el comportamiento de los átomos y las moléculas en las reacciones químicas.
Algunas características de la configuración electrónica de los átomos incluyen:
- La disposición de los electrones en un átomo está determinada por los números cuánticos de los electrones.
- La configuración electrónica de un átomo está determinada por el número de protones en su núcleo y las leyes de la mecánica cuántica.
- La configuración electrónica de un átomo se puede representar usando la tabla periódica de elementos.
- La configuración electrónica de un átomo se puede utilizar para predecir su comportamiento y propiedades químicas.
- La configuración electrónica de un átomo puede verse afectada por reacciones químicas, lo que da como resultado la formación de nuevas moléculas.
El estado de oxidación de un átomo es una medida del grado en que se ha oxidado o reducido en una reacción química. En otras palabras, es una forma de representar la cantidad de electrones que un átomo ha ganado o perdido en una reacción química. El estado de oxidación de un átomo generalmente se representa mediante un superíndice en el símbolo químico del elemento y puede ser positivo, negativo o cero. Por ejemplo, el estado de oxidación del oxígeno en el agua (H2O) es -2, porque el oxígeno ha ganado dos electrones en la reacción. El estado de oxidación de un átomo está determinado por un conjunto de reglas y puede usarse para predecir el resultado de una reacción química.
El estado físico (sólido, líquido o gas) de un elemento está determinado por su temperatura y presión. A una temperatura y presión dadas, los elementos con puntos de fusión y ebullición bajos serán gases, los elementos con puntos de fusión y ebullición intermedios serán líquidos y los elementos con puntos de fusión y ebullición altos serán sólidos. Por ejemplo, a temperatura y presión ambiente, elementos como el helio y el hidrógeno, que tienen puntos de fusión y ebullición bajos, serán gases, mientras que elementos como la plata y el cobre, que tienen puntos de fusión y ebullición altos, serán sólidos. El número de protones en el núcleo determina el número atómico del elemento y su posición en la tabla periódica, lo que puede proporcionar información general sobre sus propiedades, como sus puntos de fusión y ebullición. Sin embargo, el estado físico específico de un elemento a una temperatura y presión dadas dependerá de sus puntos de fusión y ebullición, no de su número de protones.
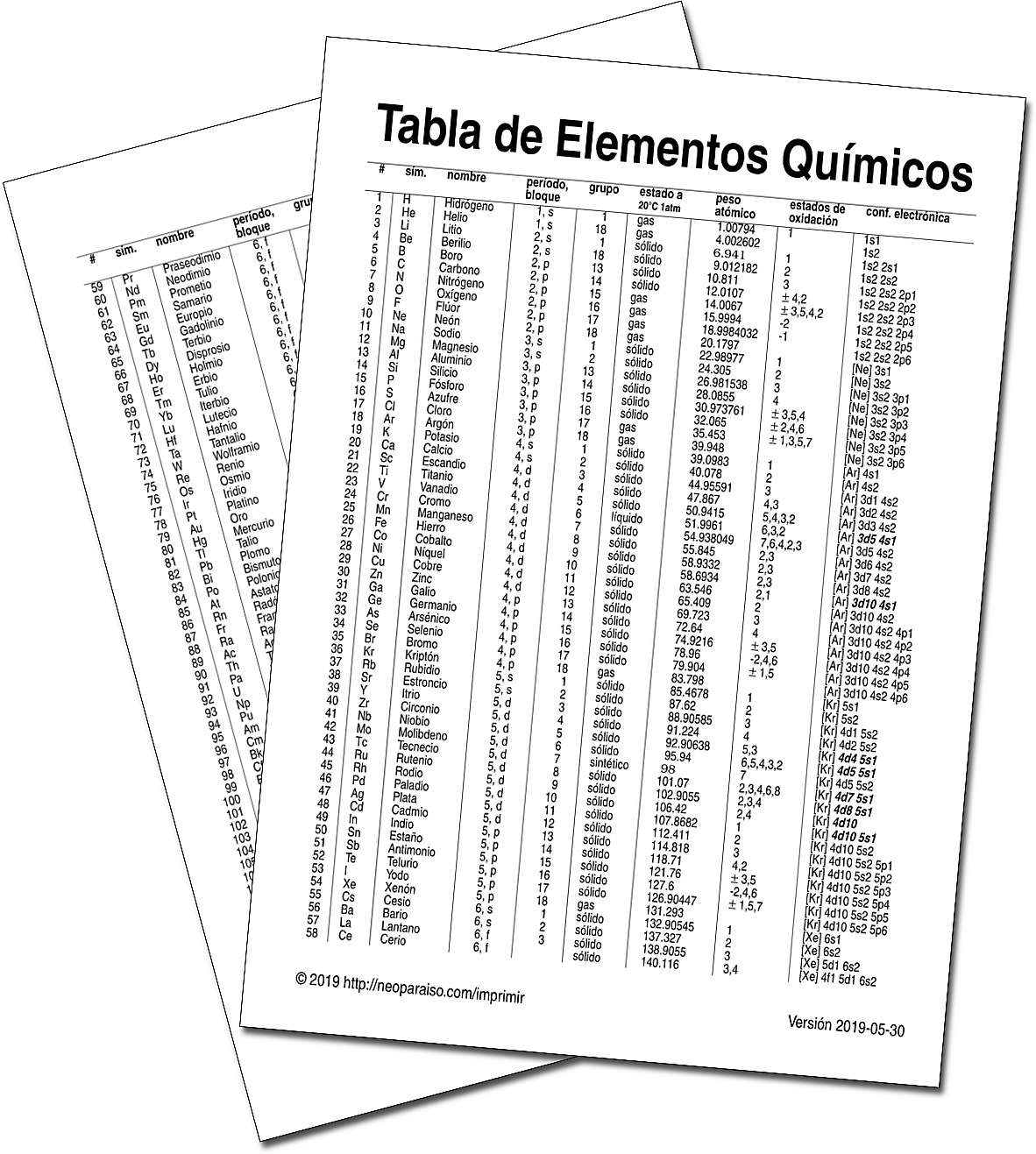
Los elementos químicos en la tabla son: hidrógeno, helio, litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor, neón, sodio, magnesio, aluminio, silicio, fósforo, azufre, cloro, argón, potasio, calcio, escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre, zinc, galio, germanio, arsénico, selenio, bromo, kriptón, rubidio, estroncio, itrio, circonio, niobio, molibdeno, tecnecio, rutenio, rodio, paladio, plata, cadmio, indio, estaño, antimonio, telurio, yodo, xenón, cesio, bario, lantano, cerio, praseodimio, neodimio, prometio, samario, europio, gadolinio, terbio, disprosio, holmio, erbio, tulio, iterbio, lutecio, hafnio, tantalio, wolframio, renio, osmio, iridio, platino, oro, mercurio, talio, plomo, bismuto, polonio, astato, radón, francio, radio, actinio, torio, protactinio, uranio, neptunio, plutonio, americio, curio, berkelio, californio, einsteinio, fermio, mendelevio, nobelio, lawrencio, rutherfordio, dubnio, seaborgio, bohrio, hassio, meitnerio, darmstadtio, roentgenio, ununbio, ununtrio, ununquadio, ununpentio, ununhexio, ununseptio y ununoctio.
Esta tabla contiene 118 elementos químicos, con su número atómico, símbolo, nombre, período, bloque, grupo, estado físico en condiciones naturales, peso atómico (con los elementos que tienen isótipos en otro tipo de letra), estados de oxidación de los elementos, y configuración electrónica (con las excepciones en negrilla). Consta de dos páginas A4 y está en formato PDF (10KB).